






《分析化学第六章氧化还原滴定PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.72 MB,总共有80页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 80页
- 1.72 MB
- VIP模板
- ppt
- 数字产品不支持退货
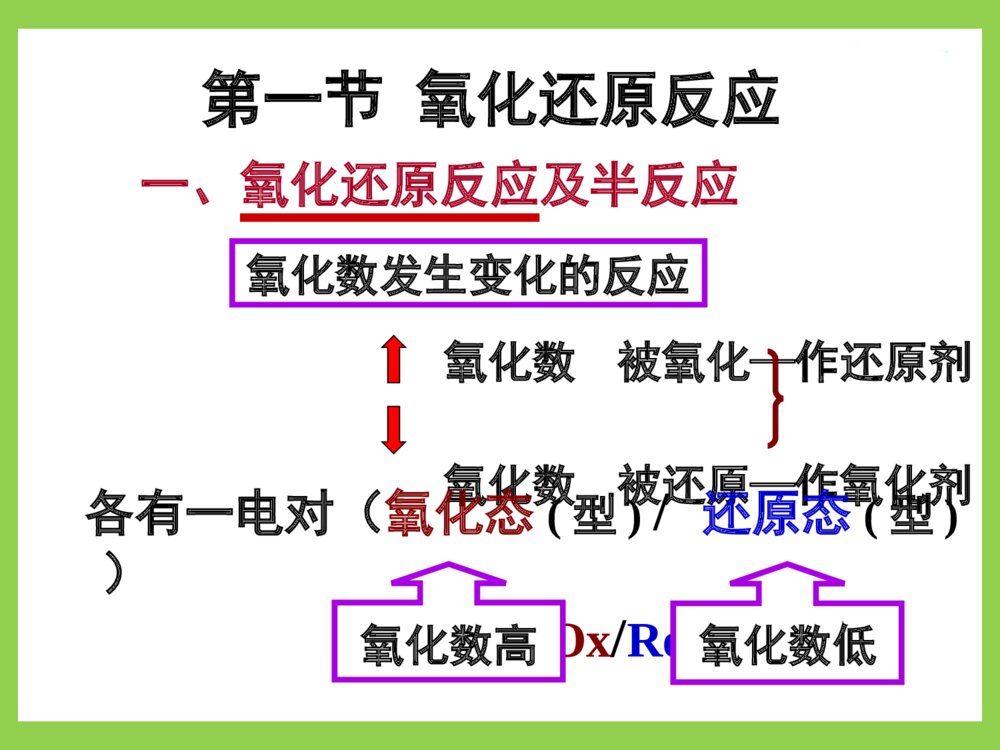
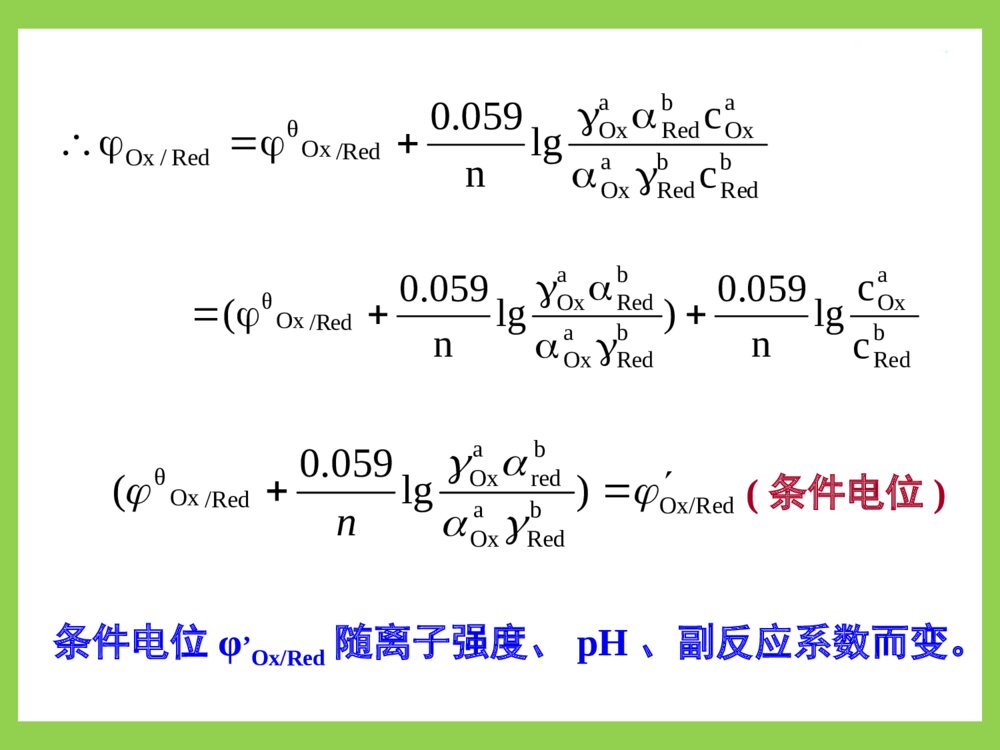
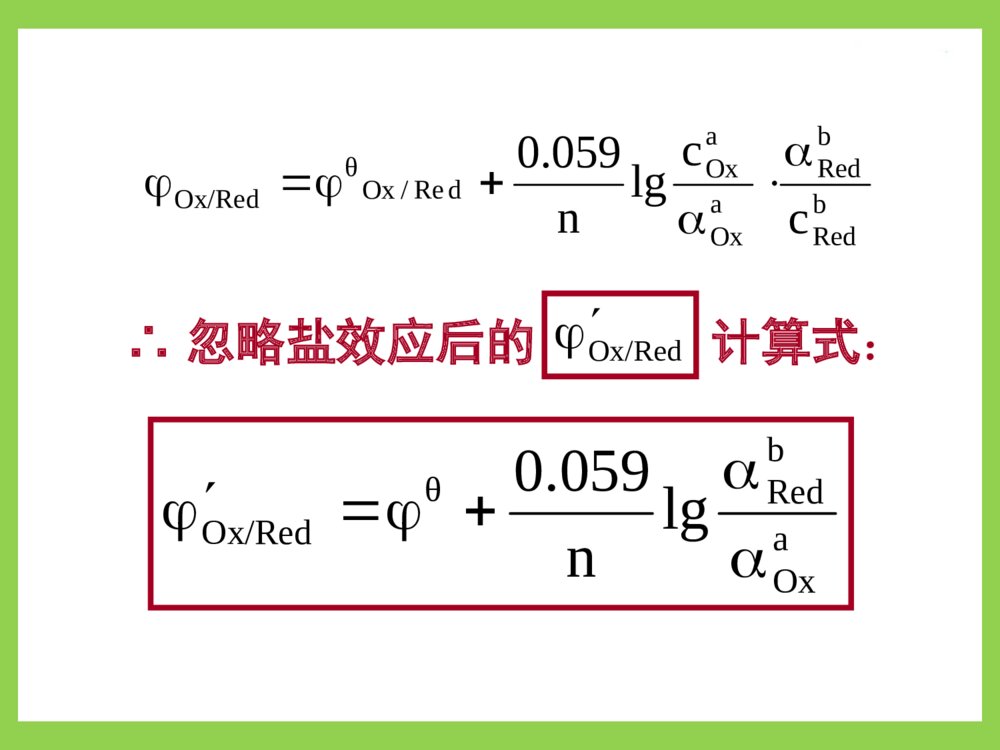
第六章氧化还原滴定法oxidation-reductiontitration应用广,可测:反应机理复杂:影响因素多,速率慢。须控制条件才能使反应完全、定量、快速。按滴定剂分类:高锰酸钾法、碘量法、重铬酸钾法、碘酸钾法、硫酸铈法、亚硝酸钠法……氧化、还原性物质与氧化、还原剂定量反应的物质第一节氧化还原反应一、氧化还原反应及半反应氧化数发生变化的反应氧化数被氧化—作还原剂氧化数被还原—作氧化剂各有一电对(氧化态(型)/还原态(型))Ox/Red氧化数高氧化数低例:Ce4++Fe2+Ce3++Fe3+Ce4+的氧化值↓,它被还原,作氧化剂;Fe2+的氧化值↑,它被氧化,作还原剂。电对1,2中的氧化态(型)还原态(型)OX1OX2Red2Red11.Ce4+/Ce3+Ce4+Ce3+2.Fe3+/Fe2+Fe2+Fe3+氧还反应中可作氧化剂还原剂氧化还原反应方向:氧化剂电对Ox1+ne→Red1还原剂电对Red2ne→Ox2氧化还原反应:Ox1+Red2→Red1+Ox2φOx/Red大者为氧化剂,发生还原反应;φOx/Red小者为还原剂,发生氧化反应。半反应:氧化还原方程式配平(离子-电子法)例:写出KMnO4+Na2C2O4→Mn2++CO2↑的反应式。步骤:⑴写半反应中的反应物和主要产物。MnO4→Mn2+;C2O42→CO2↑⑵配平半反应式:以H2O配平O,H+配平H,e配平电荷。MnO4+8H++5e→Mn2++4H2O;C2O422e→2CO2↑⑵配平半反应式:以H2O配平O,H+配平H,e配平电荷。MnO4+8H++5e→Mn2++4H2O;C2O422e→2CO2↑⑶配平得失电子数后两式相加×2)MnO4+8H++5e→Mn2++4H2O;×5)C2O422e→2CO2↑(+2MnO4+16H++5C2O42→2Mn2++10CO2↑+8H2O碱性条件则最后两边同加OH二、条件电位及其影响因素1.条件电位对于电极反应aOx+nebRed)25(lg059.0οbRedaOxOx/RedθOx/RedCaan;c]Ox[OxOxOxOxbRedbRedaOxaOxbRedaOx/RedOxθRed/Oxcclgn059.0RedRedRedRedc]d[Re其Nernst方程:aOxaRedbRedbRedaOxaOxbRedaOx/RedOxθRed/Oxcclgn059.0Ox/RedbRedaOxbredaOx/RedOxθ)lg059.0(n条件电位φ’Ox/Red随离子强度、pH、副反应系数而变。(条件电位)bRedaOxbRedaOxbRedaOx/RedOxθcclgn059.0)lgn059.0(bRedaOxθlg059.0n2.影响φ’Ox/Red因素⑴盐效应仅考虑此影响时:但γOx,γRed精确值难求,又各种副反应的影响远大于盐效应∴常忽略盐效应,忽略后的计算式:bRedbRedaOxaOxdRe/OxθbadRe/OxθOx/Redcclgn059.0]Red[]Ox[lgn059.0bRedbRedaOxaOxdRe/OxθOx/Redcclgn059.0aOxbRedθOx/Redlgn059.0∴忽略盐效应后的计算式:Ox/Red⑵酸效应H+或OH参加电极反应时Ox或Red为弱酸、弱碱时pH影响极大!例:对于下列电极反应①H3AsO4+2H++2eHAsO2+2H2Oφθ=0.56V②I2+2e2Iφθ=0.54V两电极φθ值相差小,电极反应①有H+参加,所以pH大小决定电池反应方向!电极①φH3AsO4/HAsO2值随pH值改变:432243432243AsOH2HAsOθHAsOAsOHAsOHHAsO2HAsOAsOHθ2243θα][Hαlgn059.0cclgn059.0αc][Hαclgn059.0]HAsO[]][HAsOH[lgn059.0由下两式可求得副反应系数:3a3a2a1a2a1a123AsOHAsOH]H[KKKKK]H[K][H]H[14343]H[]H[1aHAsOHAsO22K⑶生成沉淀的影响生成↓改变[Ox]或[Red]从而改变φ例:Cu2++eCu+φθCu2+/Cu+=0.16VI2+2e2IφθI2/I=0.54V当pH≈8时φ’H3AsO4/HAsO2=0.10V<φ’I2/I=0.54V反应方向:HAsO2+I2+2H2OH3AsO4+2H++2I当[H+]≈5mol/L时φ’H3AsO4/HAsO2=0.60V>φ’I2/I反应方向:H3AsO4+2H++2IHAsO2+I2+2H2O将一定pH值代入上两式得:反应2Cu2++2I2Cu++I2似乎不能进行,但由于Cu++I→CuI↓使[Cu+]↓φ’Cu2+/Cu+↑Cu2+氧化性↑Ksp,CuI=[Cu+][I]=1.1×1012;[Cu+]=Ksp/[I]。代入Nernst方程:222222222CuCu/CuCuspCu/θCuCu/θ/CuCulg059.0]I[lg1059.0]Cu[/lg059.0cKccnCuCuCuCu此实验条件对Cu2+无明显副反应αCu2+≈1标态下[I]=1mol/L/II12/CuCu2287.0101.11lg059.016.0所以上述正反应十分完全。222222CuCu/CuCuspCuCu/Cuθ/CuCuclg059.0Kc]I[lg1059.0此实验条件对Cu2+无明显副反应αCu2+≈1标态下[I¯]=1mol/L⑷生成配合物的影响利用此影响可消除某些离子对主反应的干扰例:φ’Fe3+/Fe2+=0.77V,Fe3+可氧化I干扰其与Cu2+的反应。加入NaF,使[F]=1.0mol/L322323FeFeFe/Feθ/FeFelg1059.0与氧化态生成配合物,φ’↓与还原态生成配合物,φ’↑06.12306.12230.928.533221)F(FeFeFeFe/Feθ/FeFe101101101101]F[]F[][F1lg1059.03322323αFe2+≈1/II06.12/FeFe223)V(058.0101lg059.077.0三、氧化还原反应的程度反应的条件平衡常数Ḱ↑,反应愈彻底。1.Ḱ与两电对φ́的数学关系:对于反应n2Ox1+n1Red2n2Red1+n1Ox2Ox1+n1eRed1Red2n2eOx22222122RedOx2/RedOx/RedOx2cclgn059.0111111RedOx1/RedOx/RedOx1cclgn059.0反应达平衡时φ1=φ2,即:22221111RedOx2/RedOxRedOx1/RedOxlg059.0lg059.0ccnccn两边同乘n1n2得:121222212111nRednOxRed/Ox21nRednOx/redOx21cclg1059.0nncclg1059.0nn059.0)(nncccclg2121nRednOxnRednOx12212112121222212111RedOxRed/Ox21RedOx/redOx21lg1059.0lg1059.0nnnnccnnccnn059.0lg21nnK公式表明:φ́↑,n1n2↑,则lgḰ↑,突跃↑。n2Ox1+n1Red2n2Red1+n1Ox22.用于滴定分析的氧化还原反应的必备条件)nn(310lg1010lg21)nn(3n3n32121滴定分析要求反应完全程度达99.9%以上,即:212121)(3059.0lg059.0nnnnKnn∴氧化还原反应能用于滴定分析的必备条件是:满足lgḰ≥3(n1+n2)或φ́≥0.059×3(n1+n2)/n1n2212112212112nnnnnRednOxnRednOx%)1.0(%)1.0(%)9.99(%)9.99(lgcccclgKlg结论:反应类型n1:n2lgḰ∆φ’1:1≥6≥0.35V1:22:1不考虑类型时:∆φ’≥0.3~0.4V氧化还原反应即能用于滴定分析。∴氧化还原反应能用于滴定分析的必备条件是:满足lgḰ≥3(n1+n2)或φ́≥0.059×3(n1+n2)/n1n2≥9≥0.27V常用的φ́查附表7-2,若无则用条件近似的φ́或́φθ。p.113判断在1.0mol/LH2SO4溶液中Ce4+溶液例2能否滴定Fe2+溶液;反应完全程度如何?解⑴:滴定反应为Ce4++Fe2+=Ce3++Fe3+查得:0.5mol/LH2SO4溶液中φ́Ce4+/Ce3+=1.44V;1.0mol/LH2SO4溶液中φ́Fe3+/Fe2+=0.68V。φ́=1.44―0.68=0.76(V)>0.35V,∴能!⑵:lgḰ=n1n2∆φ́/0.059=0.76/0.059=12.88>6Ḱ=7.6×1012反应进行完全!四、氧化还原反应速度多为分步完成的复杂反应,故反应速度慢;1.浓度:c↑,r↑但一般不符合质量作用定律。2.温度:T↑10℃,r↑2~3倍。如KMnO4氧化H2C2O4须加热至75~85℃3.催化剂:正催化剂能显著加速反应如KMnO4在强酸性条件下作氧化剂时,其产物Mn2+为催化剂─自身催化作用。影响因素内因─本性;外因─浓度、温度、催化剂第二节氧化还原滴定的基本原理一、滴定曲线可用电位滴定仪测绘;对称电对滴定体系可推算如下对称电对:氧化态与还原态组成相同,在电极反应中系数相同的电对。如Fe3+/Fe2+,Zn2+/Zn,Cu2+/Cu+,Sn4+/Sn2+…非对称电对如:MnO4/Mn2+,I2/I…曲线纵标:反应系统(反应液)的φ曲线横标:加入滴定剂体积(TV)或滴定百分数(%)例:在1mol/LH2SO4中,用0.1000mol/LCe(SO4)2溶液滴定20.00ml0.1000mol/LFeSO4溶液。求算:滴定曲线解析:滴定过程中对于反应Ce4++Fe2+Ce3++Fe3+氧化剂和还原剂电对始终处于平衡态,即每一瞬间,两电对φ值相同。解⑴滴定前:由空气氧化产生微量Fe3+无法算。⑵sp前0.02ml时:用φFe3+/Fe2+计算⑶sp后0.02ml:用φCe4+/Ce3+计算)V(86.0%1.0%9.99lg059.068.0lg059.0232323FeFe/FeFe/FeFecc见p.476)V(26.1%9.99%1.0lg059.044.1lg059.0343434CeCe/CeCe/CeCecc23233434FeFe/FeFeSPCeCe/CeCeSPcclg059.0;cclg059.0⑷sp时:所余Ce4+Fe2+极少,两电对φ均无法求算sp时cCe3+=cFe3+;cCe4+=cFe2+;二者φ相等。233423342334/FeFe/CeCeFeCeFeCe/FeFe/CeCeSPlg059.02cccc2.估算滴定突跃范围公式2334/FeFe/CeCeSP2)V(06.1268.044.122334/FeFe/CeCeSP滴定曲线形状如p.112图6-1滴定突跃范围:φ=0.86~1.26(V)3059.03059.0滴定剂滴定剂被测物被测物nnsp前0.1%sp后0.1%3.φSP计算式:当n1,n2均不等于1时2222RedOx/RedOx2SP2lg059.0ccnn电对Ox/Red的求φ公式两边同乘n1得:1111RedOx/RedOx1SP1lg059.0ccnn同理可得:两式相加:(n1+n2)φSP=n1φ’1+n2φ’2+0.059lgcOx1cOx2cRed1cRed2∴φSP=n1φ’1+n2φ’2n1+n2两对称电对反应其比值总是为1。例如:设两电极反应中n1=2,n2=1则Ox1+2Red2Red1+2Ox2nRed2=2nOx1,nOx2=2nRed1滴定过程中,两电对共处于同一溶液中∴cRed2=2cOx1,cOx2=2cRed1cOx1cOx2cRed1cRed2cOx1·2cRed1cRed1·2cOx1∴==14.影响突跃范围主要因素①K’↑突跃范围↑②φ’↑,突跃范围↑φ’>0.3~0.4可滴定(以指示剂指示终点)。φ’=0.2~0.3可滴定(用电位法确定终点)。φ’<0.2完全不能滴定。二、指示剂常用的有五类1.氧化还原指示剂(本身为弱的氧化剂或还原剂)InOx+neInRed两种型体颜色不同RedOxRedOxRedOxInIn/InIn/InInlg059.0ccnRedOxRedOx/InIn/InIn10110RedOxInIncc⑴当即cInOx=cInRed为理论变色点⑵当显InOx色显InRed色为理论变色范围n059.0RedOxRedOx/InIn/InIn⑶氧化还原指示剂选择原则变色范围落入突跃范围内;φ’InOx/InRed尽量靠近φSP。常用的这类In的φ’见p.114表6-42.自身指示剂标准溶液色深,滴定产物色浅或无色。如:KMnO4滴定还原性物质,终点为微红;I2滴定还原性物质,终点微浅黄。3.特殊指示剂能与某种Ox或Red产生色变(专属In)如:用于碘量法的淀粉指示剂,能吸附I2产生蓝色。5.不可逆指示剂在微过量标准溶液存在下发 生不可逆色变。 如溴酸钾法使用的甲基红或甲基橙。 微过量的KBrO3酸性条件下析出Br破坏 指示剂的呈色结构。4.外指示剂与反应物发生反应,不能加入 被滴定液中。 如重氮化滴定法使用的KI-淀粉糊(或 试纸)。此法操作麻烦,引入误差大。三、试样预处理滴定前将被测组分改变为合适价态的操作预处理试剂必备条件:1.能定量地氧化或还原被测组分。2.与被测组分的反应具有选择性。3.与被测组分反应速度快。4.过量试剂易除去。MnO4(NH4)2Fe(SO4)2过量(NH4)2S2O8滴定介质H2SO4,Ag+催化例:Mn2+无合适滴定剂第四节高锰酸钾法一、基本原理1.KMnO4的氧化性在酸性溶液中MnO4+8H++5e4H2O+Mn2+(无色)在弱酸性、中性或弱碱性溶液中MnO4+2H2O+3e4OH+MnO2(棕色s)在强碱性溶液中MnO4+eMnO42(绿色)φΘ1.51V0.57V0.54V∴滴定条件:一般为强酸性(1~2mol/L硫酸溶液);有机物分析采用强碱性。⒉指示剂: 自身指示剂,滴定过量0.1%时 KMnO4标准溶液c≥0.002mol/L可明显指示终点。 c<0.002mol/L,可选适当的氧化还原指示剂。3.自身催化反应: 在强酸性条件下,Mn2+催化KMnO4与还原剂的反应。 ∴滴定速度应先慢后快二苯胺或二苯胺磺酸钠二、KMnO4标准溶液的配制与标定1.配制:⑴称取稍多于理论量的固体试剂配制近似浓度溶液。⑵微沸1h,放置7~10天,砂芯漏斗过滤后避光保存。2.标定:基准物质Na2C2O4,H2C2O4·2H2O,Fe……(易纯化,稳定,不含结晶水,105~110℃烘2h)实验条件:⑴将Na2C2O4加热75~85(℃>90℃C2O42分解);⑵以H2SO4调[H+]至0.5~1.0mol/L;⑶滴速先慢后快。KMnO4溶液的准确浓度计算:nMnO4-=nC2O42-)KMnO()OCNa(5)OCNa(2)KMnO(44224224VMmc25O8H10CO2MnH61O5CMnO22222424标定反应:实验条件:⑴将Na2C2O4加热75~85(℃>90℃C2O42分解);⑵H2SO4调[H+]至0.5~1.0mol/L;⑶滴速先慢后快。例:0.1861gKHC2O4在酸性介质中恰能与30.00mlKMnO4反应。求:KMnO4的浓度。解:2MnO4―+5HC2O4―+11H+=2Mn2++10CO2↑+8H2O)mol/L(01936.003000.02.12851861.02)KMnO(4c三、应用: 可直接或间接测定多种无机物和有机物1.直接滴定法: 在强酸性介质下,测还原性物质如:测量Fe2+、C2O42-、H2O2、As(Ⅲ)、Sb(Ⅲ)等2.返滴定法:与其它标准溶液配合,测氧化性物质如:与Na2C2O4标准液配合测MnO4、MnO2、PbO2、CrO42、S2O82-、ClO3、BrO3、IO3等3.间接滴定法:测非氧化性、还原性物质如:测量Ca2+、Ba2+等KMnO4标准溶液不够稳定,且能与很多具有还原性的物质发生反应,滴定选择性比较差。四、应用举例⒈双氧水中H2O2的测定KMnO4标准液在H2SO4介质中直接滴定滴定反应:H2O2的浓度计算:)(2)KMnO()KMnO(5)OH(4422双氧水VVcc2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O⒉化学需氧量的测定ChemicalOxygenDemand(COD) 水样中加入一定量的H2SO4及KMnO4标准溶液,加热氧化后,剩余的KMnO4用一定量、过量的Na2C2O4还原,再用KMnO4标准溶液返滴定。2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O4MnO4-+5C+12H+=4Mn2++5CO2↑+6H2O水样VcVVVc100032])(5245)(45[)Lmg,COD(O42244OCNaKMnO21KMnO12式中:V1、V2分别为KMnO4开始加入的体积和回滴过量Na2C2O4用去的体积。⒊Ca2+离子的测定Ca2+CaC2O4↓(NH4)2C2O4热稀H2SO4H2C2O4KMnO4标准溶液滴定Ca2++C2O42=CaC2O4↓CaC2O4+H2SO4=CaSO4+H2C2O42MnO4+5H2C2O4+6H+=2Mn2++5CO2↑+8H2OCa2+的质量分数计算:)(2)Ca()KMnO()KMnO(5)Ca(2442试样mMVcCaC2O4+H2SO4=CaSO4+H2C2O42MnO4+5H2C2O4+6H+=2Mn2++5CO2↑+8H2OCa2++C2O42=CaC2O4↓nCa2+=nH2C2O4=nKMnO425第三节碘量法一、基本原理利用I2的氧化性,I的还原性进行滴定⒈直接碘量法 I2标准液滴定强还原性物质(碘滴定法)∵3I2+6OH=IO3+5I+3H2O⑴滴定pH条件:pH<9.0一、基本原理⒈直接碘量法⑵指示剂I2自身水溶液中终点浅黄;CCl4中紫红。淀粉指示剂,终点蓝色,30秒内不褪。 ①用直链可溶性淀粉配;②适度加热溶解; ③新鲜配制,加防腐剂。如HgI2; ④使用pH>2(防水解)<9(防碘歧化); ⑤滴定前加入。⑶I2标准溶液I2腐蚀性强、易挥发,须用标定法配制。①配制:I2(s)+KI(s)+少许水研磨近似cI2液少量HCl,水(防歧化,中和Na2CO3)砂芯漏斗过滤(除I2↓)避光贮存②标定:用基准物As2O3或与Na2S2O3标准溶液比较溶解反应As2O3+2NaOH(过量)2NaAsO2+H2O标定反应HAsO2+I2+2H2OH3AsO4+2I+2H+以HCl中和并酸化NaHCO3pH8~9I2+I→I3⑷应用举例:①维生素C含量的测定(直接碘量法)CCCCCCHOHOHHOHHOI2HOHCCCCCCHOOOHOHHOHOHO++2HI弱碱性条件下VitC易被空气氧化,强酸性时I被氧化为I2,故应在稀HAc溶液中滴定。计量关系:n(C6H8O6)=n(I2)②测定Na2SO3SO32+I2+H2O=SO42+2HI由于能被I2氧化的物质不多,且此法不能在强碱性溶液中进行,故直接碘量法的应用受限制。I2+2e2I基本反应为:SO32-+H2O-2eSO42-+2H+⒉间接碘量法氧化性物质+过量I¯定量产生I2还原性物质+定量过量I2余量I2(滴定碘法)滴定Na2S2O3与I2反应慢或可溶性差者⑴基本反应测氧化性物质时的预反应:2I¯I2+2e¯滴定反应:I2+2S2O32¯=S4O62¯+2I¯⑵pH条件碱性:酸性:在中性、弱酸性介质中进行S2O32¯→SO42¯;I2→I¯+IO3¯S2O32¯→S↓+SO2↑;2I¯→I2⑶指示剂淀粉溶液,近终点(亮黄)加入2ml,终点时蓝色褪去。若立即返蓝应滴入Na2S2O3至无色,5’后返蓝为正常。⑷Na2S2O3标准溶液的配制与标定Na2S2O3·5H2O含杂质、易风化、潮解、易分解标定用基准物如K2Cr2O7、KIO3、KBrO3等O2SO42-、S↓CO2S↓、HSO3–①配制新鲜冷蒸馏水配近似c溶液蔽光放置7~10天砂芯漏斗过滤去S↓ 蔽光储存少量Na2CO3(抑菌)②用基准物质标定如K2Cr2O7、KIO3、KBrO3、K3[Fe(CN)6]等Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O滴定反应:I2+2S2O32-=S4O62-+2I-)OSNa()OCrK()OCrK(6)OSNa(322722722322VMmc置换反应:[H+]≈0.8~1.0mol/L;I过量2~3倍条件条件:滴定前稀释(↓酸度;↓cCr3+)③计量关系:nS2O32-=2nI2=2(3nCr2O72-)=6nCr2O72-④计算式:3.误差主要来源及减小方法⑴防止I2挥发置换反应:过量I¯,室温,碘瓶中滴定:快滴慢摇⑵防止I被空气氧化滴定:酸度、避光、预除氧化催化剂Cu、NO2…等,快滴慢摇4.应用实例⑴漂白粉中有效氯(Cl%)测定ClCa+2H+Ca2++HClO+HClClO主要成分(有效氯)Cl2+H2O置换反应滴定反应2I¯+Cl2↑=I2+2Cl¯I2+2S2O32¯=S4O62¯+2I¯2I¯+Cl2↑=I2+2Cl¯I2+2S2O32¯=S4O62¯+2I¯置换反应1001000)(Cl%SClOSNa322mMcV滴定反应计量关系nCl=2nI2=2nNa2S2O3/2=nNa2S2O3计算式注意mS数值须根据样品溶液配制过程确定例如按照p.117例6-7的操作步骤:0.50000.50000.5Sm⑵葡萄糖含量测定过程加I2(定量过量)IO(定量产生)氧化葡糖余量IOIO3(定量产生)3I2标准Na2S2O3OH滴定(1mol)歧化(1/3mol)(1mol)OH(1mol)歧化(1mol)(1mol)H+加I计量关系n葡糖=nIO-=nI2=nNa2S2O312计算式:%1001000])(21)[(SOSNaI3222mMcVcV葡萄糖葡萄糖%=⑶CuSO4测定(间接碘量法)反应2Cu2++4I2CuI↓+I2滴定标准Na2S2O3条件为防止CuI与I2共沉淀产生δ,近终点时加SCN使CuI↓转化为CuSCN↓释放I2,减小误差。∵SCN可还原I2计量关系n(Cu2+)=2n(I2)=n(Na2S2O3)计算式:%1001000)(%SCuSOOSNaCuSO43224mMcV课堂练习一、选择题1.下述物质中可作自身指示剂的是A.IB.KMnO4C.Na2S2O3D.I22.氧化还原指示剂的理论变色范围是A.B.±1C.±0.059D.±RedOx/InInRedOx/InInRedOx/InInRedOx/InIn0.059nB,DD4.关于淀粉指示剂,下列说法错误的是A.用于直接或间接碘量法中终点均为蓝色。B.用直链淀粉配制。C.应新鲜配并加防腐剂。D.直接或间接碘量法中均应在滴定前加入。A,D3.n1=n2=1的氧化还原反应能进行直接滴定的必备条件是A.△φ’≥0.27VB.△φ’≥0.35VC.lgK’≥6D.lgK’≥9B,C5.下列对于间接碘量法的叙述中错误的是A.测定Ox时,置换反应须加入过量2~3倍的KI。B.置换反应要在碘瓶中进行约10分钟。C.应在剧烈振荡下缓缓加入滴定剂。D.终点到达后5分钟返蓝为正常。C6.K2Cr2O7标准溶液滴定Fe2+反应式为:6Fe2++Cr2O72+14H+=6Fe3++2Cr3++7H2O,Fe与K2Cr2O7的计量关系为A.nFe=nK2Cr2O7B.nFe=3nK2Cr2O7C.nFe=6nK2Cr2O7D.nFe=nK2Cr2O7l/6C8.在Zn2+/Zn电极溶液中加入NaOH使生成Zn(OH)2沉淀,将φ’Zn2+/ZnA.降低B.升高C.不变D.不确定A7.为防止I被空气氧化产生误差,下述滴定条件叙述中错误的是A.应避免阳光直射。B.预除氧化催化剂C.滴定pH应为中性或弱酸性D.慢滴快摇D二、判断题1.φ’是热力学常数,电对一定φ’也一定。×,电对一定,条件变,条件电位φ’也变。2.KMnO4滴定可加任何强酸调pH至酸性。×,HCl有还原性,HNO3有氧化性,均不行。3.用Ox滴定Red,滴定过程中Ox的φ’逐渐 减小,Red的φ’逐渐增大,只有sp时二者 的φ’相等。×,滴定过程中,两电对φ’始终相等。(√)三、填充题1.强酸性条件下KMnO4氧化Red,它自身转 化为————,是该反应的—————————。2.对称电对间的氧还反应φSP=————————。212211nnnnMn2+自身催化剂3.氧还滴定电位突跃范围主要受———和———影响,上述因素———突跃范围愈大,TE%————。K’φ’愈大愈小4.KMnO4滴定法既可测定Red又可测定Ox。√,直接滴定法测Red,返滴定法测Ox。4.间接碘量法又称为—————法,测定Ox时,加入过量的————,产生的——用——————标准溶液滴定;测Red时,加入定量、过量的————,再用——————标准溶液滴定————量的———。滴定碘KII2Na2S2O3Na2S2O3I2I2剩余5.反应Cu++I=CuI↓使 Cu2+/Cu+电对的φ’Cu2+/Cu+值_______(降低?升高?)。升高6.φөH3AsO4/HAsO2=0.56v,φөI2/I=0.54v________(酸性?碱性?)条件下可用间接碘量法测定H3AsO4。7.间接碘量法的误差来源是___________和I被空气中O2氧化。8.以K2Cr2O7标定Na2S2O3溶液,置换反应的pH条件是_____(中性?酸性?碱性?);滴定反应的pH条件是中性或弱酸性。强酸性I2的挥发酸性四、计算题1.计算K2Cr2O7标准溶液滴定Fe2+反应的平衡常数(25℃);若sp时cFe3+=0.05000mol/L,要使反应定量进行(sp时cFe2+≤106mol/L),须溶液pH为多少?查表:φΘCr2O72/Cr3+=1.33V;φΘFe3+/Fe2+=0.771V。解:⑴6Fe2++Cr2O72+14H+=6Fe3++2Cr3++7H2OlgK===56.8n1n2△φ1×6×(1.330.771)0.0590.059)V(05.1)05000.031(]H[1061lg6059.033.1]H[lg6059.021462Cr14OCrθ2SPSP327212cc)V(05.11005000.0lg059.0771.0lg059.06FeFeθ1SP231cc⑵令电对1为Fe3+/Fe2+;电对2为Cr2O72/Cr3+81.1807.1pH1056.1]H[1052810167.01079.21016.3]H[1016.30167.0]H[10167.05.28059.06)33.105.1(0167.0]H[10167.0lg22864291429214621462146SP0167.0]H[10167.0lg6059.033.105.122.称取红丹试样(含Pb3O4,M=685.6g/mol) 0.2500g,用HCl溶解后于100ml量瓶中定容, 取20.00ml加0.5000mol/LK2Cr2O725.00ml, 将析出的PbCrO4↓滤过、洗涤、溶解后加过量KI和淀粉溶液,以0.1000mol/LNa2S2O3 溶液滴定耗去6.00ml滴定剂求试样中Pb3O4的质量分数(Pb3O4%=?)反应:⑴1molPb3O4与K2Cr2O7生成3molPbCrO4↓⑵置换反应CrO42+8H++3e→Cr3++4H2O(×2+)2I2e→I2(×32CrO42+6I+16H+=2Cr3++3I2+8H2O⑶滴定反应I2+2S2O32=2I+S4O62解:nPb3O4=(1/3)nPbCrO4;nPbCrO4=(2/3)nI2=(1/3)nS2O32nPb3O4=(1/9)nS2O32%41.91%100100000.202500.090.1006.68500.61000.0%10010000.10000.209)(%OPbSOPbOSNa4343322mMcV解:nPb3O4=(1/3)nPbCrO4;nPbCrO4=(2/3)nI2=(1/3)nS2O32nPb3O4=(1/9)nS2O32课外作业p.125~1262.4.5.限于碘量法和KMnO4法,说明如何判断终点6.8.(同5)10.16.13.2Cu2++4I2CuI↓+I2I2+2S2O32=S4O62+2I



















